Электричество: общие понятия. Молекула вещества – мельчайшая частица, сохраняющая его свойства Малейшей частицей вещества сохраняющей его свойства является
А) атом Б) молекула
А) жидкости Б) газы
1.твердое тело 2. жидкость 3. газ
1.Мельчайшей частицей вещества, сохраняющей его свойства, является
А) атом Б) молекула
В) броуновская частица В) кислород
2. Броуновское движение – это ….
А) хаотическое движение очень мелких твердых частиц, находящихся в жидкости
Б) хаотическое проникновение частиц друг в друга
В) упорядоченное движение твердых частиц, находящихся в жидкости
Г) упорядоченное движение молекул жидкости
3. Диффузия может происходить …
А) только в газах Б) только в жидкостях и газах
В) только в жидкостях Г) в жидкостях, газах и твердых телах
4. Не имеют собственной формы и постоянного объёма…
А) жидкости Б) газы
В) твердые тела Г) жидкости и газы
5. Между молекулами существует….
А) только взаимное притяжение Б) только взаимное отталкивание
В) взаимное отталкивание и притяжение Г) не существует взаимодействия
6. Диффузия протекает быстрее
А) в твердых телах Б) в жидкостях
В) в газах Г) во всех телах одинаково
7. Какое явление подтверждает, что молекулы взаимодействуют друг с другом?
А) броуновское движение Б) явление смачивания
В) диффузия Г) увеличение объёма тела при нагревании
8. Соотнесите агрегатное состояние вещества и характер движения молекул:
1.твердое тело 2. жидкость 3. газ
А) скачками меняют своё положение
Б) колеблются около определенной точки
В) беспорядочно двигаются во всех направлениях
9. Соотнесите агрегатное состояние вещества и расположение молекул:
1.твердое тело 2. жидкость 3. газ
А) беспорядочно, близко друг к другу
Б) беспорядочно, расстояние в десятки раз больше самих молекул
В) молекулы расположены в определенном порядке
10. Соотнесите положение о строении вещества и его опытное обоснование
1. все вещества состоят из молекул, между которыми есть промежутки
2. молекулы непрерывно и беспорядочно движутся
3. молекулы взаимодействуют друг с другом
А) броуновское движение Б) смачивание
В) увеличение объёма тела при нагревании
Тема урока: Обобщение темы «Первоначальные химические понятия» Цель урока:
повторить и обобщить знания учащихся о первоначальных химических представлениях;
закрепить понимание химических формул, уравнений реакций;
совершенствовать коммуникативные способности и навыки.
Задачи:
1. Воспитательная:
воспитание самостоятельности, чувства товарищества, сотрудничества;
формирование логического и абстрактного мышления;
формирование нравственных качеств – коллективизма, способности к взаимовыручке, творчества.
2. Образовательная:
обобщить знания учащихся;
выделить наиболее общие и существенные первоначальные химические представления – вещества, явления, химические формулы и уравнения;
научить начальным мировоззренческим понятиям.
3. Развивающая:
развитие умений учебно-познавательной деятельности;
развитие интеллекта, культуры устной и письменной речи;
развитие логического мышления и внимания;
развитие умения использовать изученный материал в практической деятельности.
Оборудование:
таблица Д.И. Менделеева;
карточки с порядковым номером учащегося;
карточки с заданиями;
оборудование для опытов,
экран счета.
презентация «Первоначальные химические понятия»
проектор;
компьютер или ноотбук
Тип урока: комбинированный урок
План урока:
Организационный момент.
Проверка домашнего задания.
Этап обобщения и систематизации знаний.
Рефлексия.
Подведение итогов урока.
Домашнее задание
Ход урока
I Организационный момент.
Здравствуйте, ребята! Кто сегодня отсутствует?
Тема нашего урока: «Повторение. Первоначальные химические представления». Ребята, сегодня целью нашего урока является: систематизировать и обобщить знания о веществах, явлениях, формулах на две команды. Вы будете соревноваться друг с другом и заодно повторите пройденную тему, а я буду контролировать и оценивать ваши знания и отражать их в экране счета. Ну как? Готовы приступить?
Каждом участнику раздаются карточки с его порядковым номером.
II Актуализация знаний.
Фронтальная работа с классом. За правильный ответ присуждается 1балл
Разминка. Вопросы:
Что изучает химия?
Какие изменения происходят во время химических реакций?
Приведите примеры химических реакций: а) в промышленности;
б) в природе;
в) в быту.
Исходя их каких свойств применяются в быту:
а) стекло; б) резину; в) бетон; г) медь
Дайте определения следующим терминам:
Молекула, атом, валентность, химическая формула, химический элемент.
Какие законы вы уже изучили?
Что такое химическое уравнение?
Назовите типы химических реакций, приведите примеры
III Этап обобщения и систематизации знаний.
1 конкурс
А) Химический диктант «Физические и химические явления»
Нужно отметить ответы буквами «Х» (химические явления) или «Ф»(физические явления)
I вариант
Скисание молока
Аромат духов
Гниение листьев
Фотосинтез
Образование зеленого налета на медных вещах
Ответы I вариант- ХФХХХ
II вариант
Испарение спирта
Горение дров
Засахаривание варенья
Ковка металла
Ржавление металла
II вариант- ФХФФХ
Б) Химический диктант «Вещества и смеси»
Нужно отметить ответы буквами «В» или «С»
I вариант II вариант
Дистиллированная вода 1. Медь
Почва 2. Воздух
Сахар 3. Фосфор
Гранит 4. Поваренная соль
Речная вода 5. Серная кислота
Ответ: I вариант- В С В СС II вариант- ВСВВВ
2конкурс -“Валентность” Члены команд получают карточки с заданиями.
Задание А
Нужно определить валентность химических элементов.Высший балл- 5 баллов
I вариант Зная, что валентность хлора равна единице, определите валентность другого элемента в данных формулах
CaCl2 , N Cl3 , HCl , PCl5 , Al Cl3
II вариант Зная, что валентность кислорода равна двум, определите валентность другого элемента в данных формулах
MnO, P 2O 5 , CO 2 , Mn 2 O 7, K 2O
Заданиe Б
Составьте формулы химических соединений
I вариант Са(II) и О(II) , Na (I) и S(II) , Mg (II) и S (II) , AL(III) и O (II) , Pb (IV) и O (II) .
II вариант
Sn (IV) и O(II) , C(IV) и O (II) , Mg (II) и O(II) , S (IV) и O(II) , Fe (III) и O (II) .
3 конкурс- Химический хоккей
Учитель: Вам было задано домашнее задание: приготовить по 3 вопрос для другой команды. Сейчас, ребята мы вами поиграем в хоккей. Для этого мы с вами дадим командам названия: « защитники» и «нападающие» . Каждая команда будет задавать свои вопросы по одному, а противоположная команда – отвечать. За каждый правильный ответ присуждается 1 балл. За интересный вопрос также можно заработать 1балл. Максимальный балл за этот конкурс- 6 баллов.
(Команды по одному задают вопросы и отвечают на них)
4 конкурс –« Химический опыт»
Оборудование: чашка со смесью из древесных и железных опилок, чашка со смесью из крахмала и сахарного песка, стаканы пустые, стаканы с водой, стеклянная палочка, фильтрованная бумага, воронка, штативы, спиртовка, магнит,
Учитель: Пришла пора выяснить как вы можете обращаться с химической посудой и проводить опыты. Первым делом нужно будет вспомнить правила техники безопасности при выполнении опытов. К столу для опытов вызываются по три человека с каждой команды. Для каждой команды дается смесь, состоящая из двух веществ. Ваша задача: с помощью ваших знаний разделить эти смеси на вещества,из которых они состоят. максимальный балл за этот конкурс – 5баллов
После выполнения этого задания члены команд читают задание и подробно рассказывают о проделанном опыте
I вариант: Разделить смесь, состоящую из крахмала и сахарного песка II вариант: Разделите смесь, состоящую из железных и древесных опилок
5 конкурс- «Уравнения химических реакций и типы реакций»
Командам раздаются карточки с заданиями.
Учитель: 5 конкурс называется «Уравнения химических реакций и типы реакций» У вас карточки с заданиями В них уравнения химических реакций. Нужно вместе пропущенных точек поставить нужные знаки химических элементов, расставить коэффициенты и указать тип химической реакции.Максимальный балл- 3балла- (учитывается скорость выполнения задания, команда, выполнившая задание быстрее, получает плюс 1 балл)
I вариант
? + O 2 MgO реакция ………………
FeO + H2 Fe + H 2O реакция ………………
AuO Au + ? реакция ………………
II вариант
? +HCl FeCl 2+ H 2 реакция ………………
H 2+ Br 2 ? реакция ………………
HgO Hg + O2 реакция ………………
6 конкурс –Из истории химии»
Учитель: Командам было задано домашнее задание: подготовить выступление об ученых, которые внесли достойный вклад в развитие «Атомно-молекулярного учения» или явились его основоположниками. Слово предоставляется командам.За выполнение этого задания команда может заработать 3 балла Учащиеся выступают с сообщениями Роберте Бойле и Антуане Лавуазье.
Выступления первой команды
Роберт Бойль -английский химик, физик, теолог. Родился в семье протестантов 25 января 1627 г. в замке Лисмор в Ирландии. Его отцом был аристократ Ричард Бойль очень богатый человек, авантюрист по натуре, покинувший Англию в 1588 г. в 22-летнем возрасте. Мать Роберта, Кэтрин Фэнтон, была уже второй женой Ричарда Бойля. Его первая жена умерла вскоре после рождения первого ребёнка. Роберт Бойль был младшим, четырнадцатым ребёнком в семье Бойлей, и седьмым, любимым сыном Ричарда Бойля. Когда родился Роберт, его отцу было уже 60 лет, а матери 40. Конечно, Роберту Бойлю повезло в том, что его отец был одним из самых богатейших людей в Великобритании Родители Роберта Бойля полагали, что воспитание и образование дети должны получать вне семьи. Поэтому в 1635 г., в возрасте 8 лет, маленький Роберт вместе с одним из братьев был отправлен для получения образования в Англию. Они поступили в модный Итонский колледж, в котором обучались дети знатных вельмож. Условия для учёбы в Итоне у молодых Бойлей были достаточно тепличные. Ричард Бойль в ноябре 1638 г. забирает своих детей из Итона. Образование Роберта продолжается дома под наблюдением одного из священников отца. В 1638 г. Роберт Бойль вместе со своим наставником отправляется в путешествие по странам Европы, продолжает своё образование во Флоренции и в Женевской академии. В Женеве он усиленно изучает математику, французский и латинский языки, риторику и богословие. В начале 1642 г. Бойль посетил Флоренцию, город, в котором жил и творил великий Галилео Галилей. К сожалению, как раз во время пребывания Бойля во Флоренции, Галилео Галилей умер. Бойль пронёс свою любовь к философии Галилео через всю жизнь, сохраняя в своем научном творчестве веру в возможность изучения мира через законы математики и механики. В 1644 г. после смерти отца Роберт Бойль вернулся в Англию и поселился в своем имении Стелбридж, в котором почти безвыездно прожил 10 лет, занимаясь исследованиями в области естественных наук, уделяя вместе с тем много времени религиозным и философским вопросам. Надо отметить, что теологией Роберт Бойль занимался всю свою жизнь, причём очень серьёзно и увлечённо. В 1654 г. Роберт Бойль переехал в Оксфорд, где оборудовал лабораторию и с помощью специально приглашенных ассистентов проводил опыты по физике и химии. Одним из таких ассистентов был Роберт Гук. И хотя Р.Бойль находился в статусе резидента Оксфордского университета почти 12 лет, он никогда не имел никакой университетской степени или диплома. Диплом доктора медицины (Оксфорд, 1665 г.) был его единственным дипломом. В 1680 г. Роберт Бойль был избран очередным президентом Лондонского Королевского Общества, однако он отклонил эту честь, потому что требуемая при этом присяга нарушила бы его религиозные принципы. Возможно, по религиозным убеждениям Роберт Бойль всю жизнь прожил холостым, и никогда не женился. В 1668 г. Бойль получил степень почетного доктора физики Оксфордского университета и в том же году переехал в Лондон, где поселился вместе со своей сестрой и продолжал свою научную деятельность.
Научные достижения Роберта Бойля. В 1654 г. Р.Бойль ввёл в науку понятие химического анализа состава тел. В 1660 г. Р.Бойль получил ацетон, перегоняя ацетат калия.16764065405 К сожалению, Бойль так и не смог отказаться от своей веры в алхимию. Он верил в превращение элементов, и даже в 1676 г. сообщил Лондонскому Королевскому обществу о своем стремлении превратить ртуть в золото. Он искренне полагал, что находится на пути к успеху в этих опытах.
В 1663 г. Бойль открыл цветные кольца в тонких слоях, названные впоследствии ньютоновскими. В 1663 г. он обнаружил в лакмусовом лишайнике, произрастающем в горах Шотландии, кислотно-основной индикатор лакмус, который и применял в своих исследованиях. Бойль много занимался изучением химических процессов, протекающих при обжиге металлов, сухой перегонке древесины, превращениях солей, кислот и щелочей. В 1680 г. он разработал новый способ получения фосфора из костей, получил ортофосфорную кислоту и фосфин. Умер Роберт Бойль в Лондоне 30 декабря 1691 г., оставив будущим поколениям богатое научное наследие. Бойлем было написано множество книг, некоторые из них вышли в свет уже после смерти ученого, так как часть рукописей была найдена позднее в архивах Лондонского Королевского общества. Он был похоронен в Церкви Saint-Martin-in-the-Fields рядом с сестрой. Позже церковь была уничтожена, и, к сожалению, не сохранилось каких-либо записей или свидетельств о том, куда были перемещены его останки.
Выступления другой команды
Антуан Лоран Лавуазье - (1743-1794), французский химик, один из основоположни-ков современной химии. Антуан Лоран Лавуазье родился в семье адвоката 28 августа 1743 года. Первые годы жизни ребенок провел в Париже, в переулке Пеке, окруженном садами и пустырями. Мать его умерла, родив еще девочку, в 1748 году, когда Антуану Лорану было всего пять лет. Первоначальное образование он получил в коллеже Мазарини. Эта школа была устроена кардиналом Мазарини для знатных детей, но в нее принимали экстернов и из других сословий. Она была самой популярной школой в Париже.
Антуан учился отлично. Как многие из выдающихся ученых, он мечтал сначала о литературной славе и, находясь еще в коллеже, начал писать драму в прозе «Новая Элоиза», но ограничился только первыми сценами. По выходе из коллежа Лоран поступил на факультет права, - вероятно, потому, что его отец и дед были юристами и эта карьера начинала уже становиться традиционной в их семействе: в старой Франции должности обыкновенно передавались по наследству.
В 1763-м Антуан Лоран получил степень бакалавра, в следующем году - лиценциата прав. Но юридические науки не могли удовлетворить его безграничной и ненасытной любознательности. Он интересовался всем - от философии Кондильяка до освещения улиц. Он впитывал знания, как губка, всякий новый предмет возбуждал его любопытство, он ощупывал его со всех сторон, выжимая из него все, что возможно.
Вскоре, однако, из этого разнообразия начинает выделяться одна группа знаний, которая все более и более поглощает его: естественные науки.
Первые работы Лавуазье были сделаны под влиянием его учителя и друга Гэтара. После пяти лет сотрудничества с Гэтаром, в 1768 году, когда Лавуазье исполнилось 25 лет, он был избран членом Академии наук.
Антуан Лавуазье вскоре женился на дочери генерального откупщика Польза. В 1771 году Антуану Лавуазье было 28 лет, а его невесте - 14. Несмотря на молодость невесты, брак оказался счастливым. Лавуазье нашел в ней деятельную помощницу и сотрудницу в своих занятиях. Она помогала ему в химических опытах, вела журнал лаборатории, переводила для мужа работы английских ученых. Даже сделала рисунки для одной из книг. Детей у них не было.
В жизни Антуан Лавуазье придерживался строгого порядка. Он положил себе за правило заниматься наукой шесть часов в день: от шести до девяти утра и от семи до десяти вечера. Один день в неделю посвящался исключительно науке. С утра А. Лавуазье запирался в лаборатории со своими сотрудниками, тут они повторяли опыты, обсуждали химические вопросы, спорили о новой системе. Он тратил огромные суммы на устройство приборов, представляя в этом отношении совершенную противоположность некоторым из своих современников.
В 1775 году Антуан Лавуазье представил академии мемуар, в котором состав воздуха был впервые точно выяснен. Воздух состоит из двух газов: «чистого воздуха», способного усиливать горение и дыхание, окислять металлы, и «мифического воздуха», не обладающего этими свойствами. Названия кислород и азот были даны позднее.
Плодотворны были и результаты управления Лавуазье пороховыми заводами в 1775-1791 годах. За это дело он взялся со своей обычной энергией.
Во время Французской революции, как один из откупщиков, ученый Антуан Лавуазье попал в тюрьму. 8 мая 1794 года состоялся суд. По сфабрикованному обвинению 28 откупщиков, в том числе и Лавуазье, были приговорены к смертной казни. Лавуазье шел четвертым по списку. Перед ним казнили его тестя Польза. Затем наступила его очередь.
IV .Рефлексия
Учитель: Ребята, вот и подходит к концу наш урок. Я благодарю вас за активное участие на уроке, за помощь товарищам по команде.
У каждого из вас свои впечатления от урока. Я хочу попросить вас высказаться об урок применяя данные фразы:
Учащиеся по кругу высказываются одним предложением, выбирая начало фразы из рефлексивного экрана на доске:
сегодня я узнал…
было интересно…
было трудно…
я выполнял задания…
я понял, что…
теперь я могу…
я почувствовал, что…
я приобрел…
я научился…
у меня получилось …
я смог…
я попробую…
меня удивило…
мне захотелось…
V. Подведение итогов урока
В конце урока подводтся итог.Подчитываются баллы каждого учащегося и ставятся оценки за участие и ответы на уроке. Определяется выигравшая команда,выделяются лидеры
Оценки за баллы:
“5” – за 21 и больше баллов
“4”- за 17-20 баллов
“3” – за 12 -16 баллов
VI. Домашнее задание
Подготовиться к контрольной работе по теме”Первоначальные химические понятия”
Молекулярная структура вещества. Скорости газовых молекул.
Молекулярно-кинетической теорией МКТ называется теория, объясняющая свойства вещества, исходя из его молекулярного строения. Основные положения молекулярно-кинетической теории: все тела состоят из молекул; молекулы постоянно движутся; молекулы взаимодействую друг с другом.
Молекула – мельчайшая частица вещества, сохраняющая свойства данного вещества.
Атомы – наименьшая частица химического элемента. Из атомов состоят молекулы.
Молекулы постоянно движутся . Доказательством этого положения является диффузия – явление проникновения молекул одного вещества в другое. Диффузия происходит и в газах, и в жидкостях, и в твёрдых телах. С увеличением температуры скорость диффузии увеличивается. Открытое Броуном движение частичек краски в растворе названо броуновским движением и тоже доказывает движение молекул.
Строение атома . Атом состоит из положительно заряженного ядра, вокруг которого вращаются электроны.
Ядро атома состоит из нуклонов (протон, нейтрон). Заряд ядра определяется числом протонов. Массовое число определяется числом нуклонов. Изотопы – это атомы одного и того же элементы, ядра которых содержат разное количество нейтронов.
Относительная атомная масса М– масса одного атома в единицах атомной массы (1/12 массы атома углерода). Относительная молекулярная масса – М - масса молекулы в единицах атомной массы.
Количество вещества определяется числом молекул. Моль – единица измерения количества вещества. Моль – количество вещества, масса которого, выраженная в граммах, численно равна относительной молекулярной массе. 1 моль вещества содержит N А молекул. N А = 6,022∙10 23 1/моль – число Авогадро . Масса одного моля в килограммах называется молярной массой – μ =М·10 -3 . 1 моль – 12гС – N А –22,4 л. газа.
Число молей определяется формулами: ν = m / μ , ν = N / N A , ν = V / V 0 .
Основная модель МКТ – совокупность движущихся и взаимодействующих между собой молекул вещества. Агрегатные состояния вещества.
Твёрдое тело : W п >> W k , упаковка плотная, молекулы колеблются около положения равновесия, положения равновесия стационарны, расположение молекул упорядоченно, т.е. образуется кристаллическая решётка, сохраняется и форма и объём.
Жидкость: W п ≈ W k , упаковка плотная, молекулы колеблются около положения равновесия, положения равновесия подвижны, расположение молекул упорядоченно в пределах 2-х, 3-х слоёв (ближний порядок), сохраняется объём, но не сохраняется форма (текучесть).
Газ: W п W k , молекулы расположены далеко друг от друга, движутся прямолинейно до столкновения друг с другом, столкновения упругие, легко меняют и форму и объём. Условия идеальности газа: W п =0, столкновения абсолютно упругие, Диаметр молекулы расстояния между ними.
Плазма – электронейтральная совокупность нейтральных и заряженных частиц. Плазма (газовая) молекулы расположены далеко друг от друга, движутся прямолинейно до столкновения друг с другом, легко меняют и форму и объём, столкновения неупругие, при столкновениях происходит ионизация, реагирует на электрические и магнитные поля.
Фазовые переходы: парообразование, конденсация, возгонка, плавление, кристаллизация.
Статистические закономерности – законы поведения большого чикла частиц. Микропараметры – параметры малых масштабов – масса, размеры, скорость и другие характеристики молекул, атомов. Макропараметры – параметры больших масштабов – масса, объём, давление, температура физических тел.
Р
Z =2 N
аспределение частиц идеального газа по двум половинкам сосуда:
Число возможных состояний Z при числе частиц N находится по формуле
Ч
Z = N! / n!∙(N-n)!
исло способов реализации состояния n / (N – n ) находится по формуле
Анализ ответов приводит к выводу – наибольшая вероятность того, что молекулы распределятся по двум половинкам сосудов поровну.
Наиболее вероятная скорость – скорость, которой обладает большинство молекул
Как вычислить среднюю скорость молекул V ср = (V 1 ∙ N 1 + V 2 ∙ N 2 + V 3 ∙ N 3)/N. Средняя скорость обычно превышает наиболее вероятную.
Связь: скорость – энергия – температура. Е ср ~ Т.
Т
E=3 kT /2
емпература определяет степень нагретости тела. Температура главная характеристика тел, находящихся в тепловом равновесии. Тепловое равновесие когда между телами нет теплообмена
Температура – мера средней кинетической энергии молекул газа. С увеличением температуры растёт скорость диффузии, увеличивается скорость броуновского движения. Формула связи средней кинетической энергии молекул и температуры выражается формулой гдк k = 1,38∙10 -23 Дж/К – постоянная Больцмана, выражающая соотношение между Кельвином и Джоулем как единицами измерения температуры.
Т
T = t + 273.
ермодинамическая температура не может быть отрицательной .
Абсолютная шкала температур – шкала Кельвина (273К – 373К).
Температурные шкалы : Цельсия (0 о С – 100 о С), Фаренгейта (32 о Ф – 212 о Ф), Кельвина (273К – 373К).
Скорость теплового движения молекул: m 0 v 2 = 3 kT , v 2 = 3 kT / m 0 , v 2 = 3 kN A T / μ

Газовые законы
Давление – это макроскопический параметр системы. Давление численно равно силе, действующей на единицу поверхности перпендикулярно этой поверхности. P = F / S . Измеряется давление в Паскалях (Па), атмосферах (атм.), барах (бар), мм.рт.ст. Давление столба газа или жидкости в поле тяготения находится по формуле P = ρgh, где ρ - плотность газа или жидкости, h – высота столба. В сообщающихся сосудах однородная жидкость устанавливается на одном уровне. Отношение высот столбов неоднородных жидкостей обратно отношению их плотностей.
Атмосферное давление – давление, создаваемое воздушной оболочкой Земли. Нормальное атмосферное давление – 760 мм.рт.ст. или 1,01∙10 5 Па, или 1 бар, или 1 атм.
Давление газа определяется числом молекул, ударившихся о стенку сосуда и их скоростью.
Средняя арифметическая скорость движения молекул газа равна нулю, потому что преимущества движения в каком-либо определённом направлении нет в силу того, что движение молекул равновероятно по всем направлениям. Поэтому для характеристики движения молекул берётся средняя квадратичная скорость . Средние квадраты скорости по осям X,Y,Z между собой равны и составляют 1/3 средней квадратичной скорости.


 Для одного моля газа
Для одного моля газа




Изобары
Р 1
закон Гей-Люссака,

V = const – изохорный процесс ,

Изохоры
V 1
закон Шарля.
Задачи: Задача № 1 . Определить полное число микросостояний шести частиц идеального газа по двум половинам сосуда, не разделённого перегородкой. Чему равно число способов реализации состояний 1/5, 2/4? При каком состоянии число способов реализации будет максимальным?
Решение. Z =2 N = 2 6 = 64. Для состояния 1/5 Z = N! / n!∙(N-n)! = 1∙2∙3∙4∙5∙6 / 1∙1∙2∙3∙4∙5= 6
Самостоятельно . Чему равно число способов реализации состояний 2/4?
Задача № 2. Найти число молекул в стакане воды (m=200г). Решение. N = m∙ N A /μ = 0,2 ∙ 6,022∙10 23 / 18 ∙ 10 -3 =67∙ 10 23 .
Самостоятельно. Найти число молекул в 2 г меди. Найти число молекул в 1м 3 углекислого газа СО 2 .
Задача № 3. На рисунке представлен замкнутый цикл в координатах P V . Какие процессы происходили с газом? Как изменялись макропараметры? Вычертить эту диаграмму в координатах VT.
С амостоятельно
вычертить диаграмму в координатах PT.
амостоятельно
вычертить диаграмму в координатах PT.
|
P |
V |
T |
|
|
1-2 |
ув |
пост |
ув |
|
2-3 |
пост |
ув |
ув |
|
3-4 |
ум |
ув |
пост |
|
4-1 |
пост |
ум |
ум |
 ешение.
ешение.
Задача № 4. «Магдебургские полушария» растягивали 8 лошадей с каждой стороны. Как изменится сила тяги, если одно полушарие прикрепить к стене, а другое будут тянуть 16 лошадей?
З адача № 5.
Идеальный газ оказывает на стенки сосуда давление 1,01∙10 5 Па. Тепловая скорость молекул 500м/с. Найти плотность газа. (1,21кг/м 3). Решение.
. Разделим на V обе части уравнения. Получим
адача № 5.
Идеальный газ оказывает на стенки сосуда давление 1,01∙10 5 Па. Тепловая скорость молекул 500м/с. Найти плотность газа. (1,21кг/м 3). Решение.
. Разделим на V обе части уравнения. Получим


μ найдём из формулы скорости молекул
Задача № 6. Под каким давлением находится кислород, если тепловая скорость его молекул 550 м/с, а их концентрация 10 25 м -3 ? (54кПа.) Решение. P = nkT, R = N A k, P= n v 2 μ / 3 N A , Т найдём из формулы
Задача №7. Азот занимает объём 1 л при нормальном атмосферном давлении. Определите энергию поступательного движения молекул газа.
Решение . Энергия одной молекулы – E o = 5 kT / 2 , энергия всех молекул в данном объёме газа – E = N 5 kT / 2 = nV 5 kT / 2, P = nkT , E = 5 PV /2 = 250 Дж.
Задача № 8. Воздух состоит из смеси азота, кислорода и аргона. Их концентрации соответственно равны 7,8 ∙10 24 м -3 , 2,1∙ 10 24 м -3 , 10 23 м -3 . Средняя кинетическая энергия молекул смеси одинакова и равна 3 ∙10 -21 Дж. Найдите давление воздуха. (20кПа). Самостоятельно.
Задача № 9. Как изменится давление газа при уменьшении в 4 раза его объёма и увеличении температуры в 1,5 раза? (Увеличится в 6 раз). Самостоятельно.
Задача № 10. Давление газа в люминесцентной лампе 10 3 Па, а его температура 42 о С. Определите концентрацию атомов в лампе. Оцените среднее расстояние между молекулами.
(2,3∙10 23 м -3 , 16,3нм). Самостоятельно.
Задача № 11. Найдите объём одного моля идеального газа любого химического состава при нормальных условиях. (22,4л). Самостоятельно.
З адача № 12
. В сосуде объёмом 4л находятся молекулярный водород и гелий. Считая газы идеальными, найдите давление газов в сосуде при температуре 20 о С, если их массы соответственно равны 2г и 4г. (1226кПа).
адача № 12
. В сосуде объёмом 4л находятся молекулярный водород и гелий. Считая газы идеальными, найдите давление газов в сосуде при температуре 20 о С, если их массы соответственно равны 2г и 4г. (1226кПа).
Решение . По закону Дальтона Р = Р 1 + Р 2 . Парциальное давление каждого газа найдём по формуле. И водород, и гелий занимают весь объём V=4л.
Задача № 13 . Определите глубину озера, если объём воздушного пузырька удваивается при подъёме со дна на поверхность. Температура пузырька не успевает измениться. (10,3м).
Решение . Процесс изотермический P 1 V 1 = P 2 V 2
Давление в пузырьке на поверхности воды равно атмосферному Р 2 = Р о Давление на дне водоёма складывается из давления внутри пузырька и давления столба воды Р 1 = Р о + ρ gh , где ρ = 1000кг/м 3 – плотность воды, h – глубина водоёма. Р о = (Р о + ρ gh ) V 1 / 2 V 1 = (Р о + ρ gh )/ 2
Задача № 14 . Цилиндр разделён непроницаемой закреплённой перегородкой на две части, объёмы которой V 1 , V 2 . Давление воздуха в этих частях цилиндра P 1 , P 2 соответственно. При снятии закрепления перегородка может двигаться как невесомый поршень. На сколько, и в какую сторону сдвинется перегородка?
Р
P 1 V 1
P 2 V 2
ешение. Если P 2 > P 1 Давление в обоих частях
P 1 V 1 = P (V 1 -∆ V)
P 2 V 2 = P (V 2 + ∆ V)
цилиндра установится одинаковое – Р. Процесс изотермический.
Разделим правые и левые части уравнений друг на друга. А затем решим уравнение относительно ∆ V.
Ответ: ((P 1 – P 2 ) V 1 V 2 )/(P 1 V 1 + P 2 V 2 .
Задача № 15 . Автомобильные шины накачаны до давления 2∙10 4 Па при температуре 7 о С. Через несколько часов после езды температура воздуха в шинах поднялась до 42 о С. Каким стало давление в шинах? (2,25∙10 4 Па). Самостоятельно.

Теория строения вещества
Закончите предложения
Мельчайшая частица вещества, сохраняющая его свойства - молекула
Молекулы состоят из атомов
У одного и того же вещества молекулы одинаковы
У разных веществ молекулы различны
При нагревании вещества размеры молекул не изменяются

«По капельке море, по былинке стог»
О каком положении теории строения вещества идет речь в этой пословице?

«Иду в воду – красен, выйду – черен»
Как изменяются расстояние между частицами вещества?

Диффузия Diffusio (лат) –распространение, растекание
Явление самопроизвольного проникновения веществ друг в друга

Диффузия в газах

Диффузия в жидкостях

Диффузия в твердых телах

Причина диффузии

Интенсивность диффузии зависит от состояния вещества

Интенсивность диффузии зависит от температуры

Броуновское движение
видимое в микроскоп перемещение очень малых частиц вещества под действием ударов молекул.

Модель «броуновского движения»

Вывод
Запах травы или запах духов
Ягод лесных аромат и цветов
Только диффузией я объясняю,
Это явление я понимаю.
Суть вся в движении частиц вещества
Все мне понятно, как дважды два.

Немного лирики… Прекрасная дама нюхала розы. И расчихалась, закапали слезы.
Неужто из - за диффузии
Бывают такие конфузии?
Объяснить поговорку
Ложка дегтя и бочку меда испортит.

Немного истории…
Английский металлург Вильям Робертс-Аустин измерял диффузию золота в свинце. Он наплавил тонкий диск золота на конец цилиндра из чистого свинца длинной 1 дюйм (2,45 см), помещал этот цилиндр в печь, где поддерживалась температура около 200 °С, и держал его в печи 10 дней. Затем он разрезал цилиндр на тонкие диски. Оказалось, что к “чистому” концу через весь свинцовый цилиндр прошло вполне измеримое количество золота.

Диффузия на кухне
Огурцы иль помидоры Засолить проблемы нет Вскипятил рассол, соль бросил, И готовы на обед.

СТРОЕНИЕ ВЕЩЕСТВА
Все вещества состоят из отдельных мельчайших частиц: молекул и атомов.
Основоположником идеи дискретного строения вещества (т.е. состоящего из отдельных частиц) считается древнегреческий философ Демокрит, живший около 470 года до новой эры. Демокрит считал, что все тела состоят из бесчисленного количества сверхмалых, невидимых глазу, неделимых частиц. "Они бесконечно разнообразны, имеют впадины и выпуклости, которыми сцепляются, образуя все материальные тела, а в природе существуют только атомы и пустота.
Догадка Демокрита была надолго забыта. Однако, его взгляды на строение вещества дошли до нас благодаря римскому поэту Лукрецию Кару: "... все вещи, как мы замечаем, становятся меньше, И как бы тают они в течение долгого века..."
Атомы.
Атомы очень малы. Их невозможно разглядеть не только простым глазом, но и с помощью даже самого мощного оптического микроскопа.
Глаз человека не способен разглядеть атомы и промежутки между ними, поэтому любое вещество кажется нам сплошным.
В 1951 году Эрвин Мюллер изобрёл ионный микроскоп, позволивший в деталях разглядеть атомную структуру металла.
Атомы различных химических элементов отличаются друг от друга. Различия атомов элементов можно определить по периодической таблице Менделеева.
Молекулы.
Молекула - это мельчайшая частица вещества, обладающая свойствами этого вещества. Так, молекула сахара - сладкая, а соли - соленая.
Молекулы состоят из атомов.
Размеры молекул ничтожно малы.
Как увидеть молекулу? - с помощью электронного микроскопа.


Как добыть молекулу из вещества? - механическим дроблением вещества. Каждому веществу соответствует определеенный вид молекул. У разных веществ молекулы могут состоять из одного атома (инертные газы) или из нескольких одинаковых или различных атомов, или даже из сотен тысяч атомов (полимеры). Молекулы различных веществ могут иметь форму треугольника, пирамиды и других геометрических фигур, а также быть линейными.

Молекулы одного и того же вещества во всех агрегатных состояниях одинаковы.

Между молекулами в веществе существуют промежутки. Доказательствами существования промежутков служат изменение объема вещества, т.е. расширение и сжатие вещества при изменении температуры
Домашняя работа.
Задание. Ответить на вопросы:
№ 1.
1. Из чего состоят вещества?
2. Какие опыты подтверждают, что ве¬щества состоят из мельчайших частиц?
3. Как меняется объём тела при изменении расстояния между частицами?
4. Какой опыт пока¬зывает, что частицы вещества очень малы?
5. Что такое молекула?
6. Что вы знаете о размерах молекул?
7. Из каких частиц состоит молекула воды?
8. Как изображается схемати¬чески молекула воды?
№ 2.
1. Одинаков ли состав молекул воды в горячем чае и в охлаждённом напитке «Кола»?
2. Почему изнашиваются подмётки у ботинок и стираются до дыр локти пиджаков?
3. Как объяснить высыхание лака на ногтях?
4. Вы проходите мимо пекарни. Из нее доносится аппетитный запах свежего хлеба…. Как это могло произойти?
Опыт Роберта Рэлея.
Размеры молекул были определены во многих опытах. Один из них провел английский ученый Роберт Рэлей.
В чистый широкий сосуд налили воду и на ее поверхность поместили каплю оливкового масла. Капля растеклась по поверхности воды и образовала круглую пленку. Постепенно площадь пленки увеличивалась, но затем растекание прекратилось и площадь перестала изменяться. Релей предположил, что молекулы расположились в один ряд, т.е. толщина пленки стала равна как раз размеру одной молекулы, и решил определить ее толщину. При этом, конечно, нужно учесть, что объем пленки равен объему капли.
По тем данным, которые были получены в опыте Рэлея, рассчитаем толщину пленки и узнаем, чему равен линейный размер молекулы масла. Капля имела объем 0,0009 см3, а площадь пленки, образовавшейся из капли, была равна 5500 см2. Отсюда толщина пленки:

Экспериментальное задание:
Проделать в домашних условиях опыт по определению размеров молекул масла.
Для опыта удобно воспользоваться чистым машинным маслом. Сначала определите объем одной капли масла. Придумайте сами, как это сделать при помощи пипетки и мензурки (можно воспользоваться мензуркой, которой отмеривают лекарства).
Налейте в тарелку воды и на ее поверхность поместите каплю масла. Когда капля растечется, измерьте диаметр пленки линейкой, положив ее на края тарелки. Если поверхность пленки не будет иметь форму круга, то или подождите, когда она примет такую форму, или сделайте несколько измерений и определите ее средний диаметр. Затем вычислите площадь пленки и ее толщину.
Какое число вы получили? Во сколько раз оно отличается от действительных размеров молекулы масла?
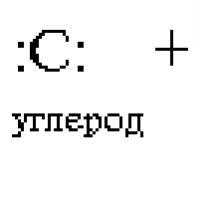 Ковалентные связи с участием атома углерода Радикал
Ковалентные связи с участием атома углерода Радикал Королева Марго (Маргарита де Валуа) - биография, фото, личная жизнь принцессы
Королева Марго (Маргарита де Валуа) - биография, фото, личная жизнь принцессы Годы правления князя ярослава мудрого на руси
Годы правления князя ярослава мудрого на руси Как называется профессия который знает много языков
Как называется профессия который знает много языков Геркулес (мультсериал) Фил из геркулеса что за животное
Геркулес (мультсериал) Фил из геркулеса что за животное Факторы внешней среды, воздействующие на организм в процессе его жизнедеятельности, роста и развития
Факторы внешней среды, воздействующие на организм в процессе его жизнедеятельности, роста и развития Человек произошел от инопланетян Происхождение человека от инопланетян интересные факты
Человек произошел от инопланетян Происхождение человека от инопланетян интересные факты